Что делает фтор – это что такое? Свойства фтора
это что такое? Свойства фтора
Фтор – химический элемент (символ F, атомный номер 9), неметалл, который относится к группе галогенов. Это самое активное и электроотрицательное вещество. При нормальной температуре и давлении молекула фтора является ядовитым газом бледно-желтого цвета с формулой F2. Как и другие галоиды, молекулярный фтор очень опасен и при контакте с кожей вызывает тяжелые химические ожоги.
Использование
Фтор и его соединения широко применяются, в т. ч. и для получения фармацевтических препаратов, агрохимикатов, горюче-смазочных материалов и текстиля. Плавиковая кислота используется для травления стекла, а плазма из фтора – для производства полупроводниковых и других материалов. Низкие концентрации ионов F в зубной пасте и питьевой воде могут помочь предотвратить кариес зубов, в то время как более высокие концентрации входят в состав некоторых инсектицидов. Многие общие анестетики представляют собой производные фторуглеводородов. Изотоп 18F является источником позитронов для получения медицинских изображений методом позитронно-эмиссионной томографии, а гексафторид урана используется для разделения изотопов урана и получения обогащенного урана для атомных электростанций.
История открытия
Минералы, содержащие соединения фтора, были известны за много лет до выделения этого химического элемента. Например, минерал плавиковый шпат (или флюорит), состоящий из фторида кальция, был описан в 1530 г. Георгием Агриколой. Он заметил, что его можно использовать в качестве флюса — вещества, которое помогает снизить температуру плавления металла или руды и помогает очистить нужный металл. Поэтому фтор название свое латинское название получил от слова fluere («течь»).
В 1670 году стеклодув Генрих Шванхард обнаружил, что стекло травится под действием фтористого кальция (плавикового шпата), обработанного кислотой. Карл Шееле и многие более поздние исследователи, в том числе Гемфри Дэви, Жозеф-Луи Гей-Люссак, Антуан Лавуазье, Луи Тенар, экспериментировали с плавиковой кислотой (HF), которую было несложно получить путем обработки CaF концентрированной серной кислотой.
В конце концов, стало понятно, что HF содержит ранее неизвестный элемент. Это вещество, однако, из-за его чрезмерной реактивности в течение многих лет выделить не удавалось. Его не только трудно отделить от соединений, но оно тут же вступает в реакцию с другими их компонентами. Выделение элементарного фтора из плавиковой кислоты чрезвычайно опасно, и ранние попытки ослепили и убили нескольких ученых. Эти люди стали известны как «мученики фтора».

Открытие и производство
Наконец, в 1886 году французскому химику Анри Муассану удалось выделить фтор путем электролиза смеси расплавленных фторидов калия и плавиковой кислоты. За это он был удостоен Нобелевской премии 1906 года в области химии. Его электролитический подход продолжает использоваться сегодня для промышленного получения данного химического элемента.
Первое масштабное производство фтора началось во время Второй мировой войны. Он требовался для одного из этапов создания атомной бомбы в рамках Манхэттенского проекта. Фтор использовался для получения гексафторида урана (UF6), который, в свою очередь, применялся для отделения друг от друга двух изотопов 235U и 238U. Сегодня газообразный UF6 необходим для получения обогащенного урана для ядерной энергетики.
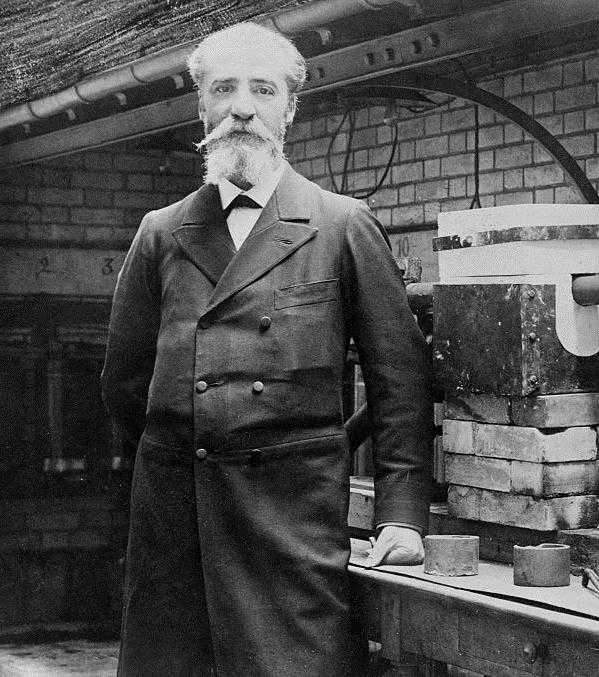
Важнейшие свойства фтора
В периодической таблице элемент находится в верхней части 17 группы (бывшая группа 7А), которую называют галогенной. К другим галогенам относятся хлор, бром, йод и астат. Кроме того, F находится во втором периоде между кислородом и неоном.
Чистый фтор – это коррозионный газ (химическая формула F2) с характерным резким запахом, который обнаруживается в концентрации 20 нл на литр объема. Как наиболее реактивный и электроотрицательный из всех элементов, он легко образует соединения с большинством из них. Фтор слишком реактивный, чтобы существовать в элементарной форме и имеет такое сродство с большинством материалов, включая кремний, что его нельзя готовить или хранить в стеклянных емкостях. Во влажном воздухе он реагирует с водой, образуя не менее опасную плавиковую кислоту.
Фтор, взаимодействуя с водородом, взрывается даже при низкой температуре и в темноте. Он бурно реагирует с водой, образуя плавиковую кислоту и газообразный кислород. Различные материалы, в том числе мелкодисперсные металлы и стекла, в струе газообразного фтора горят ярким пламенем. Кроме того, данный химический элемент образует соединения с благородными газами криптоном, ксеноном и радоном. Однако непосредственно с азотом и кислородом он не реагирует.
Несмотря на крайнюю активность фтора, сегодня стали доступны методы его безопасной обработки и транспортировки. Элемент может храниться в емкостях из стали или монеля (богатого никелем сплава), так как на поверхности этих материалов образуются фториды, которые препятствуют дальнейшей реакции.
Фториды – это вещества, в которых фтор присутствует в виде отрицательно заряженного иона (F—) в сочетании с некоторыми положительно заряженными элементами. Соединения фтора с металлами являются одними из наиболее стабильных солей. При растворении в воде они делятся на ионы. Другими формами фтора являются комплексы, например, [FeF4]—, и H2F+.
Изотопы
Существует множество изотопов данного галогена, начиная от 14F и заканчивая 31F. Но изотопный состав фтора включает только один из них, 19F, который содержит 10 нейтронов, так как только он является стабильным. Радиоактивный изотоп 18F – ценный источник позитронов.
Биологическое воздействие
Фтор в организме в основном содержится в костях и зубах в виде ионов. Фторирование питьевой воды в концентрации менее одной части на миллион значительно снижает частоту кариеса — так считают в Национальном исследовательском совете Национальной академии наук США. С другой стороны, избыточное накопление фтора может привести к флюорозу, который проявляется в крапчатости зубов. Этот эффект обычно наблюдается в местностях, где содержание данного химического элемента в питьевой воде превышает концентрацию 10 промилле.
Элементарный фтор и фтористые соли токсичны и с ними следует обходиться с большой осторожностью. Контакта с кожей или глазами следует тщательно избегать. Реакция с кожным покровом производит фтористоводородную кислоту, которая быстро проникает через ткани и реагирует с кальцием в костях, повреждая их навсегда.
Фтор в окружающей среде
Ежегодная мировая добыча минерала флюорита составляет около 4 млн т, а общая мощность разведанных месторождений находится в пределах 120 млн т. Основными районами добычи этого минерала являются Мексика, Китай и Западная Европа.
В природе фтор встречается в земной коре, где его можно найти в горных породах, угле и глине. Фториды попадают в воздух при ветровой эрозии почв. Фтор является 13-м по распространенности химическим элементом в земной коре – его содержание равно 950 промилле. В почвах его средняя концентрация – примерно 330 промилле. Фтороводород может выделяться в воздух в результате процессов горения в промышленности. Фториды, которые находятся в воздухе, в конечном итоге выпадают на землю или в воду. Когда фтор образует связь с очень мелкими частицами, то может оставаться в воздухе в течение длительного периода времени.
В атмосфере 0,6 миллиардных долей данного химического элемента присутствуют в виде солевого тумана и органических соединений хлора. В городских условиях концентрация достигает 50 частей на миллиард.

Соединения
Фтор – это химический элемент, который образует широкий спектр органических и неорганических соединений. Химики могут заменить им атомы водорода, тем самым создавая множество новых веществ. Высокореактивный галоген образует соединения с благородными газами. В 1962 году Нил Бартлетт синтезировал гексафторплатинат ксенона (XePtF6). Фториды криптона и радона также были получены. Еще одним соединением является фторгидрид аргона, устойчивый лишь при экстремально низких температурах.
Промышленное применение
В атомарном и молекулярном состоянии фтор используется для плазменного травления в производстве полупроводников, плоских дисплеев и микроэлектромеханических систем. Плавиковая кислота применяется для травления стекла в лампах и других изделиях.
Наряду с некоторыми из его соединений, фтор – это важная составляющая производства фармацевтических препаратов, агрохимикатов, горюче-смазочных материалов и текстиля. Химический элемент необходим для получения галогенированных алканов (галоны), которые, в свою очередь, широко использовались в системах кондиционирования воздуха и охлаждения. Позже такое применение хлорфторуглеродов было запрещено, поскольку они способствуют разрушению озонового слоя в верхних слоях атмосферы.

Гексафторид серы – чрезвычайно инертный, нетоксичный газ, относящийся к веществам, вызывающим парниковый эффект. Без фтора невозможно производство пластмасс с низким коэффициентом трения, таких как тефлон. Многие анестетики (например, севофлуран, десфлуран и изофлуран) являются производными фторуглеводородов. Гексафторалюминат натрия (криолит) применяется в электролизе алюминия.
Соединения фтора, в том числе NaF, используются в зубных пастах для предотвращения кариеса. Эти вещества добавляются в системы муниципального водоснабжения для фторирования воды, однако из-за воздействия на здоровье человека эта практика считается спорной. При более высоких концентрациях NaF используются в качестве инсектицида, особенно для борьбы с тараканами.
В прошлом фториды применялись для снижения температуры плавления металлов и руд и повышения их текучести. Фтор – это важный компонент производства гексафторида урана, который применяется для разделения его изотопов. 18F, радиоактивный изотоп с периодом полураспада 110 минут, излучает позитроны и часто используется в медицинской позитронно-эмиссионной томографии.
Физические свойства фтора
Базовые характеристики химического элемента следующие:
- Атомная масса 18,9984032 г/моль.
- Электронная конфигурация 1s22s22p5.
- Степень окисления -1.
- Плотность 1,7 г/л.
- Температура плавления 53,53 К.
- Температура кипения 85,03 К.
- Теплоемкость 31,34 Дж/(К·моль).
fb.ru
Фтор
| Фтор | |
|---|---|
| Атомный номер | 9 |
| Внешний вид простого вещества |
Фтор в сосуде
Бледно-жёлтый газ, чрезвычайно химически активен. Очень ядовит. |
| Свойства атома | |
|
Атомная масса (молярная масса) |
18,998403 а. е. м. (г/моль) |
| Радиус атома | 71 пм |
|
Энергия ионизации (первый электрон) |
1680,0 (17,41) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 2p5 |
| Химические свойства | |
| Ковалентный радиус | 72 пм |
| Радиус иона | (-1e)133 пм |
|
Электроотрицательность (по Полингу) |
3,98 |
| Электродный потенциал | 0 |
| Степени окисления | −1 |
| Плотность | (при −189 °C)1,108 г/см³ |
| Молярная теплоёмкость | 31,34 Дж/(K·моль) |
| Теплопроводность | 0,028 Вт/(м·K) |
| Температура плавления | 53,53 K |
| Теплота плавления | (F-F) 0,51 кДж/моль |
| Температура кипения | 85,01 K |
| Теплота испарения | 6,54 (F-F) кДж/моль |
| Молярный объём | 17,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | моноклинная |
| Параметры решётки | 5,50 b=3,28 c=7,28 β=90.0 Å |
| Отношение c/a | — |
| Температура Дебая | n/a K |
| F | 9 |
| 18,9984 | |
| [He]2s22p5 | |
| Фтор | |
Фтор — элемент главной подгруппы седьмой группы, второго периода периодической системы химических элементов Менделеева, с атомным номером 9. Обозначается символом F Fluorum. Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество
История
Схема атома фтораПервое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь семьдесят шест лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «Fluorum» (которое происходит, в свою очередь, от fluere — «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| 0,00002 | |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значимые скопления фтора содержатся разве что только в минерале флюорите.
В некоторой степени относительно богаты фтором растения чечевица и лук
Содержанием в почве фтор обязан вулканическим газам, за счет того, что в их состав обычно входит большое количество фтороводорода.
Изотопный состав
Фтор является моноизотопным элементом, так как в природе существует только один стабильный изотоп фтора
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4.722 | |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2.629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2.094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Электронное строение
Применение метода МО для молекулы F2Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — ²P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбители и 3 разрыхляющих. Очевидно, что порядок связи в молекуле равен 1.
Кристаллическая решётка
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)Кристаллическая решётка фтора в твёрдом состоянии является моноклиной гранецентрированной со следующими параметрами решётки:
| Параметр | и значение |
|---|---|
| a | 550 пм |
| b | 328 пм |
| c | 728 пм |
| α=β=γ | 90° |
Получение
Лабораторный метод получения фтораИсточником для производства фтора служит фтористый водород HF, получающийся в основном либо при действии серной кислоты H2SO4 на флюорит CaF2, либо при переработке апатитов и фосфоритов.
Лабораторный метод
Лабораторные условия — фтор можно получать с помощью химических установок. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
- K2MnF6 + 2SbF5 → 2KSbF6 + MnF3 + ½F2
- 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2
- Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Физические свойства
Слабо светло-оранжевый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (редкие исключения — фторопласты), и с большинством из них — с горением и взрывом. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
- 2F2 + 2H2O → 4HF + O2
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
- XeF8 → XeF6 + F2
- MnF4 → MnF3 + 1/2 F2
Фтор также способен окислять кислород, образуя фторид кислорода OF2.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали.
Применение в химической деятельности (химической промышленноси)
Газообразный фтор используется для получения:
гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности.
трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива
шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности
фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами
фреонов — хороших хладагентов
тефлонов — химически инертных полимеров
гексафтороалюмината натрия — для последующего получения алюминия электролизом
различных соединений фтора
Ракетная техника
- Соединения фтора широко применяются в ракетной технике как окислитель ракетного топлива.
Применение в медицине
Соединения фтора широко применяются в медицине как кровезаменители.
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариеса и флюорозу (крапчатости эмали) и остеосаркомы, соответственно.
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фтора или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 %.
Предельно допустимая концентрация связанного фторав воздухе промышленных помещениях равен 0,0005 мг/литр.
Дополнительная информация
Фториды
Соединения фтора в ракетной технике
Соединения фтора в медицине
Категория:Соединения фтора
Фтор, Fluorum, F(9)
Фтор (Fluorine, франц. и нем. Fluor) получен в свободном состоянии в 1886 г., но его соединения известны давно и широко применялись в металлургии и производстве стекла. Первые упоминания о флюорите (СаР,) под названием плавиковый шпат (Fliisspat) относятся к XVI в. В одном из сочинений, приписываемых легендарному Василию Валентину, упоминаются окрашенные в различные цвета камни — флюссе (Fliisse от лат. fluere — течь, литься), которые применялись в качестве плавней при выплавке металлов. Об этом же пишут Агрикола и Либавиус. Последний вводит особые названия для этого плавня — плавиковый шпат (Flusspat) и минеральный плавик. Многие авторы химико-технических сочинений XVII и XVIII вв. описывают разные виды плавикого шпата. В России эти камни именовались плавик, спалт, спат; Ломоносов относил эти камни к разряду селенитов и называл шпатом или флусом (флус хрустальный). Русские мастера, а также собиратели коллекций минералов (например, в XVIII в. князь П. Ф. Голицын) знали, что некоторые виды шпатов при нагревании (например, в горячей воде) светятся в темноте. Впрочем, еще Лейбниц в своей истории фосфора (1710) упоминает в связи с этим о термофосфоре (Thermophosphorus).
По-видимому, химики и химики-ремесленники познакомились с плавиковой кислотой не позднее XVII в. В 1670 г. нюрнбергский ремесленник Шванхард использовал плавиковый шпат в смеси с серной кислотой для вытравливания узоров на стеклянных бокалах. Однако в то время природа плавикового шпата и плавиковой кислоты была совершенно неизвестна. Полагали, например, что протравливающее действие в процессе Шванхарда оказывает кремневая кислота. Это ошибочное мнение устранил Шееле, доказав, что при взаимодействии плавикового шпата с серной кислотой кремневая кислота получается в результате разъедания стеклянной реторты образующейся плавиковой кислотой. Кроме того, Шееле установил (1771), что плавиковый шпат представляет собой соединение известковой земли с особой кислотой, которая получила название «Шведская кислота».
Лавуазье признал радикал плавиковой кислоты (radical fluorique) простым телом и включил его в свою таблицу простых тел. В более или менее чистом виде плавиковая кислота была получена в 1809 r. Гей-Люссаком и Тенаром путем перегонки плавикового шпата с серной кислотой в свинцовой или серебряной реторте. При этой операции оба исследователя получили отравление. Истинную природу плавиковой кислоты установил в 1810 г. Ампер. Он отверг мнение Лавуазье о том, что в плавиковой кислоте должен содержаться кислород, и доказал аналогию этой кислоты с хлористоводородной кислотой. О своих выводах Ампер сообщил Дэви, который незадолго до этого установил элементарную природу хлора. Дэви полностью согласился с доводами Ампера и затратил немало усилий на получение свободного фтора электролизом плавиковой кислоты и другими путями. Принимая во внимание сильное разъедающее действие плавиковой кислоты на стекло, а также на растительные и животные ткани, Ампер предложил назвать элемент, содержащийся в ней, фтором (греч.- разрушение, гибель, мор, чума и т. д.). Однако Дэви не принял этого названия и предложил другое — флюорин (Fluorine) по аналогии с тогдашним названием хлора — хлорин (Chlorine), оба названия до сих пор употребляются в английском языке. В русском языке сохранилось название, данное Ампером.
Многочисленные попытки выделить свободный фтор в XIX в. не привели к успешным результатам. Лишь в 1886 г. Муассану удалось сделать это и получить свободный фтор в виде газа желто-зеленого цвета. Так как фтор является необычайно агрессивным газом, Муассану пришлось преодолеть множество затруднений, прежде чем он нашел материал, пригодный для аппаратуры в опытах со фтором. U-образная трубка для электролиза фтористо- водородной кислоты при 55°С (охлаждаемая жидким хлористым метилом) была сделана из платины с пробками из плавикового шпата. После того как были исследованы химические и физические свойства свободного фтора, он нашел широкое применение. Сейчас фтор — один из важнейших компонентов синтеза фторорганических веществ широкого ассортимента. В русской литературе начала XIX в. фтор именовался по-разному: основание плавиковой кислоты, флуорин (Двигубский,1824), плавиковость (Иовский), флюор (Щеглов, 1830), флуор, плавик, плавикотвор. Гесс с 1831 г. ввел в употребление название фтор.
himsnab-spb.ru
Фтор — Циклопедия
Фтор
Химический элемент
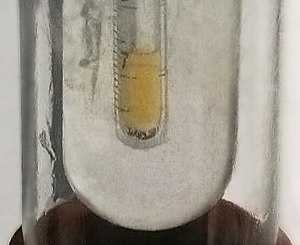 Жёлтая жидкость (при очень низких температурах), бесцветный газ (в толстых слоях — зеленовато-жёлтый)
Жёлтая жидкость (при очень низких температурах), бесцветный газ (в толстых слоях — зеленовато-жёлтый)| Символ, номер | F, 9 |
| Атомная масса | 18,9984032 а.е.м. |
| Электронная конфигурация | [He] 2s2 2p5 |
| Электроотрицательность | 3,98 по шкале Поллинга |
| Степени окисления | -1; 0 |
| Температура плавления | -219,70 °C |
| Температура кипения | -188,12 °C |
| Структура кристаллической решетки | моноклинная |
| Теплопроводность | (300 K) 0,028 Вт/(м·К) |
Фтор — химический элемент № 9 Периодической таблицы Менделеева, принадлежит группе галогенов.
[править] Характеристика
Простое вещество — фтор — бледно-желтый двухатомный газ F2 со специфическим резким запахом. Температура плавления −219,62 °С. Имеет исключительно высокую химическую активность и образует соединения со всеми элементами, кроме гелия, неона и аргона. Взаимодействие с многими элементами, оксидами и солями, водой протекает очень энергично, а с водородом и углеводородами — часто со взрывом. Фтор очень ядовит. ПДК 0,15 мг/м3. Среднее содержание фтора в земной коре 6,25· 10−2 %. Фтор выносится с верхней мантии преимущественно со щелочной базальтовой и ультрабазитовой магмой. Важнейшие минералы, обогащенные фтором: флюорит CaF2 (47,81-48,8 %), фторапатит (до 3,8 %), слюда (0,1-3,5 %), амфиболы (0,1-3,5 %), вилиомит (45,24 %), топаз (13,01-20,45 %), сфен (0,1-1,35 %), криолит (54,4 %).
Получают фтор электролизом HF в среде расплавленного КН2F3 или KHF2.
Применение в технике находят фтороорганические соединения, характеризующихся высокой термической и химической стойкостью.
Первая соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюоро». В 1771 году Карл Шееле получил плавиковую кислоту. Как один из атомов плавиковой кислоты элемент фтор был предсказан в 1810 году, но выделен в свободном виде только 76 лет спустя Анри Муассаном в 1886 году при электролизе жидкого безводного фтористого водорода, содержащего примеси кислого фторида калия KHF2.
[править] Происхождение названия
Название «фтор» (от греч. φθόρος — разрушение), предложенное Андре Ампером в 1810 году, используется только в греческом (Φθόριο) и восточно-славянских языках, а также в языках, которые позаимствовали это название с русского (например, в чувашском, таджикском или монгольском).
[править] Распространение в природе
Фтор достаточно распространен в природе. Процентное содержание его в земной коре приближается к содержанию таких элементов, как азот, сера, хром, марганец и фосфор. Промышленное значение имеют, однако, только два фтористых минерала — плавиковый шпат и криолит. Кроме того, фтор входит в сравнительно небольшом количестве в состав апатитов. При переработке природных фосфатов на искусственные удобрения в качестве побочных продуктов получают фтористые соединения.
Относительно богаты фтором растения чечевица и лук.
Содержанием в почве фтор обязан вулканическим газам, за счет того, что в их состав обычно входит большое количество фтороводорода.
Источником для производства фтора служит фтористый водород HF, получаемый в основном или при воздействии серной кислоты H2SO4 на флюорит CaF2, или при переработке апатитов и фосфоритов.
Производство фтора осуществляется электролизом расплава кислого флюорита калия KF·3HF, который образуется при насыщении расплава KF·3HF фтористым водородом до содержания 40-41 % HF.
[править] Химические свойства
Фтор образует соединения прямо или косвенно, со всеми другими элементами, включая некоторые инертные газы. С водородом фтор соединяется даже при −252 °C. При этой температуре водород превращается в жидкость, а фтор затвердевает, и все же реакция идет с таким сильным выделением тепла, что происходит взрыв.
Долгое время не было известно соединение фтора с кислородом, но в 1927 г. французским химикам удалось получить дифторид кислорода, что образуется при действии фтора на слабый раствор щелочи:
- 2F2 + 2NaOH = 2NaF + OF2 + H2O
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе из меди, алюминия и его сплавов, латуни, нержавеющей стали.
Фтор обладает уникальной способностью проявляться по запаху при концентрации 0,02 мг/м³, которая в 7,5 раза ниже принятой предельно допустимой.
Газообразный фтор служит для фторирования UF4 в UF6, применяемого для разделения изотопов урана, а также для получения трифтористого хлора ClF3 (фторирующий агент и мощный окислитель ракетного топлива), шестифтористой серы SF6 (газообразный изолятор в электротехнической промышленности).
Жидкий фтор и жидкий оксид фтора используют в качестве окислителя ракетного топлива. То же относится к производным — тетрафлуоргидразину и трифлуористому азоту (причем последний позволяет при сжигании в его атмосфере различных топлив получать очень высокие температуры).
[править] Биологическая роль
Основная роль в организме — участие в костеобразовании и процессах формирования дентина и зубной эмали. Также фтор стимулирует кроветворную систему и иммунитет, участвует в развитии скелета, стимулирует репаративные процессы при переломах костей. Предупреждает развитие сенильного остеопороза. Основные концентрации фтора в организме человека: в зубах — 246—560 мг/кг, в костях — 200—490 мг/кг, в мышцах — 2-3 мг/кг.
Суточная потребность взрослого человека составляет 2-3 мг фтора. С продуктами питания взрослый человек получает в среднем 0,8 мг фтора в сутки. Наибольшее количество фтора из продуктов содержит рыба (треска, сом), орехи, печень. Основное количество фтора поступает в организм с водой. Обычная питьевая вода содержит 1 мг фтора на 1 л. Недостаток поступления фтора в организм является одним из экзогенных этиологических факторов кариеса зубов, особенно в период их прорезывания и минерализации. В районах с низким содержанием фтора в воде проводится фторирование воды до оптимального содержания фтора — 1 мг/л. Избыточное поступление фтора в организм с водой в основном носит эндемический характер и возникает в той местности, где содержание фтора в воде превышает 2 мг/л. Приводит к возникновению флюороза, который поражает в основном постоянные зубы людей. Токсическое действие фтора также может проявляться ингибированием многих ферментных систем. Для снижения содержания фтора в такой воде проводят ее дефторирование. Фтор входит в состав ряда комплексов поливитаминов.
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Горный энциклопедический словарь: в 3 т. / Под ред. В. С. Белецкого. — Донецк: Восточный издательский дом, 2001—2004.
cyclowiki.org
Фтор (F, Fluor) — влияние на организм, польза и вред, описание
История фтора
Как и многие элементы, фтор сначала был «предсказан» теоретически, как атом плавиковой кислоты (которую открыл в 1771 году Карл Шееле) в 1810 году, и только в конце XIX столетия Анри Муассан выделил фтор в свободном виде. Своим названием фтор обязан древнегреческому слову φθόρος которое переводится как разрушение.
Общая характеристика фтора
Фтор является элементом XVII группы II периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 9. Принятое обозначение – F (от латинского Fluorum).

Нахождение в природе
Фтор в природе находится как правило в минерале под названием флюорит, который встречается в небольших количествах в почве и водах рек и океанов.
Физические и химические свойства
Фтор является химически активным неметаллом, это самый лёгкий галоген, представляет собой бледно-жёлтый газ с резким запахом, является агрессивным и ядовитым (calorizator). Температура плавления фтора – аномально низкая, поэтому элемент хранится в жидком или газообразном состоянии.

Суточная потребность во фторе
Суточная норма во фторе увеличивается по мере роста человека, от 0,5 до 0,9 мг у детей и 1,5-4 мг у взрослых женщин и мужчин.
Продукты питания богатые фтором
Основной источник фтора – питьевая вода, далее идут зелёный и чёрный чай, грецкие орехи, морепродукты, молоко, яйца, репчатый лук, чечевица, овсянка, гречка и рис, картофель, зелёные листовые овощи и говяжья печень.

Полезные свойства фтора и его влияние на организм
Фтор в организме человека:
- укрепляет иммунитет, костный скелет и зубную эмаль,
- обеспечивает рост волос и ногтей,
- стимулирует процессы кроветворения,
- выводит радикалы и тяжёлые металлы,
- предупреждает развитие остеопороза,
- предотвращает развитие кариеса.

Признаки нехватки фтора
Основными признаками нехватки фтора являются заболевания зубов и дёсен – пародонтоз и кариес.
Признаки избытка фтора
Признаками переизбытка фтора в организме человека являются замедление обмена веществ, поражение эмали зубов, деформация костей скелета, тошнота и рвота.

Применение фтора в жизни
Основное применение фтор находит как сильный окислитель в производстве ракетного топлива и химических полимеров, в медицине используется как кровезаменитель и ингредиент многих лекарственных препаратов.

Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
www.calorizator.ru
для чего полезен и в каких продуктах содержится?
СОДЕРЖАНИЕ СТАТЬИ:
Знаете ли вы, что впервые о фторе заговорили еще в конце далекого XVIII века, когда было изучено первое его соединение, плавиковый шпат, и получена плавиковая кислота?
В начале следующего века было выдвинуто предположение, что одним из атомов упомянутой кислоты является некое вещество «фтор», однако выделен он был лишь спустя 76 лет французским химиком Анри Муассаном. Все предшественники ученого, пытавшиеся получить этот газ, получали серьезные проблемы со здоровьем, а то и вовсе умирали.
Само название данного микроэлемента происходит от греческого слова «φθόρος», что означает «разрушение». И это вполне справедливо, ведь фтор является сильнейшим окислителем на нашей планете и очень опасным токсином.
Природный фтор есть в почве, а также в водах рек и океанов. В теле человека он присутствует в составе зубов и костной системы и выполняет еще целый ряд жизненно важных функций.
Нам нужно организовать свое питание так, чтобы был фтор в еде, иначе в теле могут произойти серьезные нарушения. Но об этом чуть дальше, а сейчас я расскажу вам, какие продукты содержат фтор.
К содержаниюПродукты, в которых содержится фтор
 Водоросли — надежный источник натурального фтора
Водоросли — надежный источник натурального фтораИзвестно, что большую часть данного микроэлемента человек получает из воды (это примерно 2/3 от общего количества), а с пищей – лишь минимум.
Возможно, это происходит потому, что продукты, содержащие фтор, не могут похвастаться его значительными количествами. Так как это вещество в природе концентрируется преимущественно в воде, то сам собой напрашивается вывод, что для его получения нужно употреблять еду из водоемов.
Что может выловить из океана вегетарианец? Только морские водоросли! Вот их и рекомендуют кушать тем, кто хочет восполнить свои запасы фтора.
Этот микроэлемент также присутствует в злаках – в овсе, ржи, рисе. Есть он и в гречке, которую часто ошибочно принимают за зерновую культуру. На самом деле, знакомые всем с детства маленькие треугольные зернышки – не что иное, как семена.
Так вот, чтобы получить фтор из этих источников, советую проращивать их – замачивать в воде часов на 12, а затем еще примерное на такое же время оставлять во влажном состоянии.
Из овощей можно выделить тыкву, лук и картошку, из бобовых – чечевицу, которую, к слову, тоже лучше есть так же в виде проростков. Фруктовые источники фтора – яблоки и грейпфруты. А еще можно кушать мед, грецкие орехи и пить парное молоко. При этом всю перечисленную еду сложно назвать продуктами, богатыми фтором, ведь она содержит незначительное количество данного вещества.
К содержаниюКак лучше всего употреблять фтор?
 Подумайте еще раз, прежде чем попить чаю — оно точно того стоит?
Подумайте еще раз, прежде чем попить чаю — оно точно того стоит?Многие специалисты советуют пить зеленый чай и с его помощью получать этот микроэлемент, однако он, как известно, имеет множество противопоказаний и, к тому же, является обезвоживающим напитком.
Кроме того, летучий фтор очень боится термической обработки, а чай, заваренный кипятком, вряд ли можно назвать живым продуктом. Имейте в виду эту особенность интересующего нас вещества при приготовлении пищи.
Старайтесь, если это возможно, употреблять его источники в первозданном виде, то есть сырыми. Не кладите их в алюминиевую посуду, которая также способствует утрате фтора. Также имейте в виду, что чрезмерное количество кальция, фосфора и магния затрудняет усвоение фтора.
К содержаниюИ все-таки откуда брать фтор?
 Вода, обогащенная фтором, скорее больше навредит вам.
Вода, обогащенная фтором, скорее больше навредит вам.Исследователи подсчитали, что для получения суточной нормы фтора из продуктов питания взрослому человеку придется ежедневно съедать более 300 граммов грецких орехов и выпивать не менее 20 литров парного молока! 😯
Так что же, придется регулярно получать расстройство желудка из-за обилия съеденных орехов или завести корову и буквально жить у ее вымени? Вряд ли кто-то из нас способен на такие «подвиги».
А еще в чем содержится фтор? Откуда же все-таки нам его получать? Выше я писала о том, что данный природный химический элемент есть в воде, возможно, именно по этой причине ловкие дельцы дополнительно «обогащают» ее фтором. Кроме того, посредством рекламы всем нам внушили, что чистить зубы фторированной пастой очень даже полезно. Еще бы, ведь наши собственные зубы уже содержат этот химический элемент!
Следовательно, чем больше фтора в организме, тем лучше? Увы, это великое заблуждение, которое может стоить наивным гражданам здоровья.
Раньше я не особо задумывалась о том, какой пастой я чищу зубы. По мере роста осознанности мое внимание добралось и до этого щекотливого вопроса. Я пришла к выводу, что фторированные средства для чистки зубов – зло. Равно как и все остальные химические продукты промышленного производства.
Лучше всего очищать свои зубы натуральными средствами – мисваком, травяным порошком, активированным углем, гомеопатическими пастами, солью и даже золой. Или, на худой конец, банальным зубным порошком. Но это тема для отдельной статьи.
К содержаниюЧем опасен фтор?
 Чистить зубы зубной пастой с фтором — сомнительное удовольствие.
Чистить зубы зубной пастой с фтором — сомнительное удовольствие.Сегодня же я хочу рассказать вам о вреде средств для чистки зубов, в состав которых входит герой данного материала – фтор. Фториды – соединения данного микроэлемента. Он чаще всего и находится в природе именно в таком виде. Казалось бы, эти вещества натуральны, что в них может быть опасного?
Более того, небольшое количество фторидов есть в воде, мы регулярно получаем их с пищей. Если не усердствовать с количеством данного вещества, то вреда для здоровья от него не будет.
А вот в больших количествах фтор очень токсичен – и в этом он «переплюнул» даже печально известный тяжелый металл свинец.
Теперь подумайте, какое количество этого токсина вы каждый день получаете вместе с зубной пастой. Фторид натрия, который попадет в организм в количестве от 2 до 5 граммов (в зависимости от веса и возраста), способен его убить!
Но сначала человек будет ощущать тошноту и слабость, страдать диареей. Затем начнется поражение ЦНС и сердечно-сосудистой системы. А так и до летального исхода недалеко…
Конечно, вряд ли кто-то съест за один раз весь тюбик фторированной зубной пасты. Ну, разве что самоубийца, который узнает о таком способе ухода из жизни. Однако всем нам известно, что маленькие дети любят глотать это средство для чистки зубов… А сколько фторида натрия попадает во взрослый организм со слюной во время утренних и вечерних гигиенических процедур?
Отдельная песня – фторирование воды. Во время этого процесса фториды соединяются с сульфатом алюминия и образуют опаснейшее для живых существ вещество – фторид алюминия. Этот яд молниеносно попадает в организм и отлично там накапливается, но практически не выводится.
Нарушения работы почек, болезнь Альцгеймера, маразм – вот лишь малая часть тех последствий, к которым может привести употребление воды с фтором.
Да, фториды действительно делают кости более толстыми и стимулируют их рост, однако при этом они становятся очень хрупкими и легко деформируются. Также они негативно влияют на состояние суставов. Так стоит ли оно того?
А еще чрезмерное употребление фтора превращает здоровые клетки в раковые и вызывает генетические нарушения у беременных женщин. Кроме того, такая вода и такая паста значительно снижают иммунитет и делают наше тело беззащитным перед вредоносными микроорганизмами.
Также избыток фтора в организме человека может вызывать флюороз – появление серых пятен на зубах. Женщинам особенно неприятно будет узнать о том, что фториды разрушают коллаген и, тем самым, ускоряют процессы старения.
Так что, хотите быть молодыми и здоровыми – ищите натуральную альтернативу промышленным зубным пастам и позаботьтесь о качестве своей воды!
Однажды я смотрела фильм «Эрин Брокович», в котором рассказывалось о том, как жители одного американского городка из года в год пили воду, отравленную шестивалентным хромом, а затем болели и умирали целыми семьями.
Это, конечно, другое вещество, но данная история очень ярко показывает нам, что нельзя вмешиваться в законы природы и самостоятельно снабжать организм тем, что он должен получать из природных источников.
Поэтому, прошу вас, забудьте о фторированных зубных пастах и сдайте на анализ воду, которую вы пьете каждый день. Уверена, ваше тело скажет вам за это «спасибо»!
Таковы вредные свойства фтора, если вы получаете его не из природных источников, а из его синтетических аналогов. Вот почему не стоит увлекаться и аптечными лекарствами на его основе. Сторонники здорового образа жизни предпочитают натуральные добавки к пище, содержащие фтор, например, спирулину.
Другая проблема – дефицит данного вещества, который случается не так уж редко, потому что продукты с содержанием фтора, взращиваются с помощью пестицидов. А это, безусловно, влияет на количество питательных веществ в пище и на качество их усвоения.
К содержаниюДефицит фтора: симптомы и последствия
 Когда фтора в организме не будет хватать, зубы об этом сразу скажут.
Когда фтора в организме не будет хватать, зубы об этом сразу скажут.Нехватка фтора в организме не проявляется какими-то особенными внешними признаками, но в целом ее можно определить по ряду симптомов: если вы заметили, что у вас ухудшилось состояние костной системы, а также зубов и ногтей, стали выпадать волосы и развивается анемия, то это всё может быть по причине недостатка фтора.
Вот вам хороший повод сдать анализы на наличие данного микроэлемента в вашем организме. Для того чтобы фтор поступал в ваше тело в достаточных количествах, нужно для начала узнать – а сколько это?
К содержаниюСуточная потребность во фторе
Дети до года должны получать не менее и не более 0,5 мг фтора в сутки, от 1 до 3 лет – 0,7 мг, от 3 до 6 лет – 0,9 мг, от 6 до 9 лет – 1,1 мг, от 9 до 14 лет – 1,3 мг, подростки от 14 до 18 лет – 1,5 мг.
Взрослым мужчинам и женщинам необходимо от 1,7 до 4 мг фтора ежедневно. Учтите, что будущие и кормящие мамы должны придерживаться верхней границы указанной нормы, ведь фтор для беременных и для детей очень важен.
К содержаниюДля чего нужен фтор в организме?
 Крепкие кости — задача фтора.
Крепкие кости — задача фтора.Функции фтора в нашем теле очень значимы, ведь он:
- В содружестве с кальцием и фосфором делает прочными наши зубы и кости.
- Участвует в формировании зубной эмали, а также является профилактикой кариеса.
- Необходим для роста костей и ускоряет процесс их срастания после переломов.
- Активизирует процесс кроветворения, снижает скорость производства молочной кислоты и, тем самым, уменьшает риск развития остеопороза.
- В качестве антагониста радионуклида стронция мешает ему накапливаться в костной системе и снижает его вредоносное воздействие на организм в целом.
- Обеспечивает нормальный рост волосам и ногтям.
- Наряду с другими питательными веществами способствует укреплению иммунной системы.
- Подавляет активность бактерий.
Таковы полезные свойства фтора для здоровья человека. А каково ваше мнение об этом неоднозначном веществе? Заботитесь ли вы о достаточном его поступлении в ваш организм? Если да, то каким образом? И чистите ли вы зубы «специальной волшебной» пастой с фтором?
sunmint.ru
Фтор
Фтор — элемент 17-й группы периодической системы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), второго периода, с атомным номером 9. Обозначается символом F (лат. Fluorum). Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор (CAS-номер: 7782-41-4) при нормальных условиях — двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Очень ядовит.
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «fluorum» (которое происходит, в свою очередь, от fluere — «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Получение
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение. Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве и их получают с помощью свободного фтора.
Физические свойства
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит. Фтор имеет аномально низкую температуру кипения (плавления). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами кроме, разумеется, фторидов в высших степенях окисления и редких исключений — фторопластов, и с большинством из них — с горением и взрывом. К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина: 2F2 + 2H2O → 4HF + O2 К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например: 2CoF3 → 2CoF2 + F2 MnF4 → MnF3 + 1/2 F2 Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF2 и диоксидифторид O2F2. Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Источник: Википедия
Другие заметки по химии
edu.glavsprav.ru
Фтор — Википедия. Что такое Фтор
| Внешний вид простого вещества | |
|---|---|
| Жёлтая жидкость (при криогенных температурах), бесцветный газ (в толстых слоях — зеленовато-жёлтый, н. у.)[1] | |
| Свойства атома | |
| Название, символ, номер | Фтор/Fluorum (F), 9 |
| Атомная масса (молярная масса) | 18,998403163(6)[2] а. е. м. (г/моль) |
| Электронная конфигурация | [He] 2s2 2p5 |
| Радиус атома | 73 пм |
| Химические свойства | |
| Ковалентный радиус | 72 пм |
| Радиус иона | (−1e)133 пм |
| Электроотрицательность | 3,98 (шкала Полинга) |
| Электродный потенциал | 2,87 В |
| Степени окисления | −1, 0 |
| Энергия ионизации (первый электрон) | 1680,0 (17,41) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | газ: 1,6960 г/л ж.: 1,516−188 г/см³, тв.: 1,7−228 г/см³[3] г/см³ |
| Температура плавления | 53,53 К (−219,70 °C)[3] |
| Температура кипения | 85,03 К (−188,12 °C)[3] |
| Критическая точка | 144,4 К, 5,215 МПа |
| Уд. теплота плавления | (F—F) 0,5104 кДж/моль |
| Уд. теплота испарения | (F—F) 6,544 кДж/моль |
| Молярная теплоёмкость | 31,34[3] Дж/(K·моль) |
| Молярный объём | 17,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | моноклинная |
| Параметры решётки | β = 102,17°; a=5,50 Å; b = 3,28 Å; c=7,28 Å |
| Прочие характеристики | |
| Теплопроводность | (300 K) 0,028 Вт/(м·К) |
| Номер CAS | 7782-41-4 |
Фтор (от др.-греч. φθόρος «разрушение, порча, вред», далее от φθείρω «уничтожать, истреблять, губить») — химический элемент с атомным номером 9[4]. Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится во втором периоде таблицы. Атомная масса элемента 18,998403163(6) а. е. м.[2]. Обозначается символом F (от лат. Fluorum).
Фтор — самый химически активный неметалл и сильнейший окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор при нормальных условиях — двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Фтор ядовит.
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «fluorum» (которое происходит, в свою очередь, от fluere — «течь», — по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления шлака при восстановлении металлов из руд и увеличивать текучесть его расплава).
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
В природе значимые скопления фтора содержатся в основном в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Относительно богаты фтором чечевица и лук.
Содержанием в почве фтор обязан вулканическим газам, за счёт того, что в их состав обычно входит большое количество фтороводорода.
Физические свойства
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C)[3]. Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)[6].
Электронное строение
Применение метода МО для молекулы F2Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2.
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллическая решётка
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)Фтор образует две кристаллические модификации, стабильные при атмосферном давлении:
- α-фтор — существует при температуре ниже 45,6 K, кристаллическая решетка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,550 нм, b = 0,328 нм, c = 0,728 нм, β = 102,17°, Z = 4, d = 1,97 г/см3[7][8][3];
- β-фтор — существует в интервале температур 45,6 ÷ 53,53 K, кристаллическая решетка кубической сингонии, параметры ячейки a = 0,667 нм, Z = 8, d = 1,70 г/см3[3].
Изотопный состав
Фтор является моноизотопным элементом, так как в природе существует только один стабильный изотоп фтора 19F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18mF. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4,722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2,094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами, кроме фторидов в высших степенях окисления и редких исключений — фторопластов, и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона. Ко фтору при комнатной температуре устойчивы некоторые металлы за счёт образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252°C), в магниевых сосудах для начала реакции нужен небольшой нагрев. В атмосфере фтора горят даже вода и платина:
- 2F2+2h3O→4HF↑+O2↑{\displaystyle {\mathsf {2F_{2}+2H_{2}O\rightarrow 4HF\uparrow +O_{2}\uparrow }}}
- Pt+2F2 →350−400oC PtF4{\displaystyle {\mathsf {Pt+2F_{2}\ {\xrightarrow {350-400^{o}C}}\ PtF_{4}}}}
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
- 2CoF3→2CoF2+F2↑{\displaystyle {\mathsf {2CoF_{3}\rightarrow 2CoF_{2}+F_{2}\uparrow }}}
- 2MnF4→2MnF3+F2↑{\displaystyle {\mathsf {2MnF_{4}\rightarrow 2MnF_{3}+F_{2}\uparrow }}}
Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении реагирует с криптоном и ксеноном с образованием фторидов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора[9].
Не реагирует с гелием, неоном, аргоном, азотом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
Получение
Лабораторный метод получения фтораПромышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C[10]:
- 2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑{\displaystyle {\mathsf {2K_{2}MnF_{6}+4SbF_{5}\rightarrow 4KSbF_{6}+2MnF_{3}+F_{2}\uparrow }}}
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен, кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °С, разложение фторидов серебра (слишком дорого) и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются пленкой фторидов, которая защищает от дальнейшей реакции с фтором[11]).
Применение
Фтор используется для получения:
Ракетная техника
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих ракетных топлив. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.).
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г[3]. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг[3]. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно[12].
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %[13].
Предельно допустимая концентрация связанного фтора[14] в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология
Фтор — чрезвычайно агрессивное вещество. Ядовит, сильный окислитель. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Резорбтивное действие объясняется возможностью фтора вступать в свободнорадикальные реакции с тканями организма. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век[15].
NFPA 704
См. также
Литература
- Рысс И. Г. Химия фтора и его неорганических соединений. М. Госхимиздат, 1966 г. — 718 с.
- Некрасов Б. В. Основы общей химии. (издание третье, том 1) М. Химия, 1973 г. — 656 с.
Примечания
- ↑ Фтор. Проверено 14 марта 2013. Архивировано 15 марта 2013 года.
- ↑ 1 2 Meija J. et al. Atomic weights of the elements 2013 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2016. — Vol. 88, no. 3. — P. 265–291. — DOI:10.1515/pac-2015-0305.
- ↑ 1 2 3 4 5 6 7 8 9 Раков Э. Г. Фтор // Химическая энциклопедия: в 5 т / Зефиров Н. С. (гл. ред.). — М.: Большая Российская энциклопедия, 1998. — Т. 5: Три—Ятр. — С. 197—199. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ↑ Таблица Менделеева на сайте ИЮПАК
- ↑ Главным образом в эмали зубов
- ↑ Ахметов Н. С. «Общая и неорганическая химия».
- ↑ Pauling L., Keaveny I., Robinson A. B. J. Solid State Chem., 1970, Vol. 2, Issue 2, p. 225—227.
- ↑ J. Chem. Phys. 49 (1968) 1902.
- ↑ Энциклопедический словарь юного химика. Для среднего и старшего возраста. Москва, Педагогика-Пресс. 1999 год.
- ↑ Гринвуд Н., Эрншо А. «Химия элементов» т. 2, М.: БИНОМ. Лаборатория знаний, 2008 стр. 147—148, 169 — химический синтез фтора
- ↑ Фтор в Популярной библиотеке химических элементов
- ↑ По данным National Toxicology Program
- ↑ Справочник потребителя
- ↑ в виде фторидов и фторорганических соединений
- ↑ Н. В. Лазарев, И. Д. Гадаскина. «Вредные вещества в промышленности». Том 3, страница 19.
Ссылки
wiki.sc